Основания их химические свойства и способы получения (Таблица)
Основания - это сложные вещества, в состав которых входят атомы металла и гидроксогруппы OH- (за исключением гидроксид аммония NH4OH - не содержит атомов металла).
Me+n(OH)n-1 - общая формула оснований
Me - металл
n - степень окисления металла
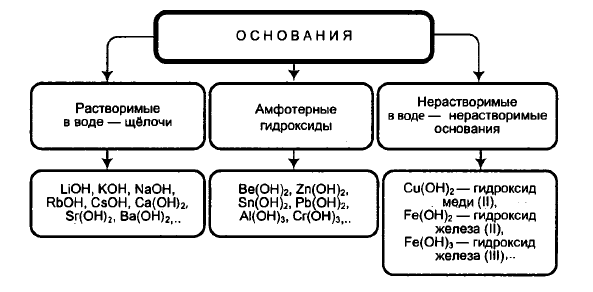
Схема классификации оснований
Все основания делятся на растворимые в воде - щёлочи, амфотерные гидроксиды, и нерастворимые основания (нерастворимые в воде).
Химические свойства оснований
|
Основания |
Химические свойства |
|
Щелочи (во всех реакциях участвуют ионы ОН-, (что видно из кратких ионных уравнений), следовательно, они обуславливают общие химические свойства щелочей) |
1. Действие на индикаторы: фенолфталеин — малиновый цвет, метилоранж — желтый цвет, лакмус — синий цвет |
|
2. диссоциация: NaOH → Na+ +ОН- При диссоциации образуются ионы ОН-, которые изменяют окраску индикаторов и придают мылкость растворам щелочей. |
|
|
3. Основание + кислота → соль + вода 2КОН + 2НСl → 2КС1 + Н20 |
|
|
4. Щелочь + кислотный оксид → соль + вода Ва(ОН)2 + СO2 → ВаСО3 + Н2O |
|
|
5. Щелочь + соль 1 → соль 2 + основание 2KOH + CuSO4 → K2SO4 + Cu(OH)2↓ |
|
|
Нерастворимые основания |
1. Основание + кислота → соль + вода 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6Н2O |
|
2. Основание → t°→ оксид + вода 2Fe(OH)3 → t°→ Fe2O3 + ЗН2O, Си(ОН)2 → t°→ СuО + Н2O |
|
|
Амфотерные гидроксиды (у амфотерных гидроксидов в кислой среде равновесие смещается в сторону образования солей, а в щелочной - в сторону образования гидрокомплексов) |
1. Амфотерный гидроксид + кислота → соль + вода Zn(OH)2 + 2НСl → ZnCl2 + 2Н2O |
|
2. Амфотерный гидроксид + щелочь → соль + вода Zn(OH)2 + 2NaOH → Na2ZnO2 + 2Н2O |
Способы получения оснований
|
Способ получения |
Примеры |
Примечание |
|
Взаимодействие металлов или их оксидов с водой |
2Na + 2Н2O → 2NaOH + Н2↑ К2O + Н2O → 2КOН |
Так можно получить только щелочи |
|
Действие щелочей на водные растворы солей |
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO |
Так можно получить нерастворимые основания |
|
Электролиз растворов солей |
2KCl + 2H2O → I, графит, электроды → 2KOH + + H2↑ + Cl2↑ |
Промышленный способ получения КОН и NaOH |
_______________
Источник информации:Насонова А.Е. Химия в таблицах. 8-11 класс. Справочное пособие, 2000
